嵌合抗原受体(Chimeric antigen receptor,CAR)-T 细胞(CAR-T)是指通过基因修饰技术,将病毒等载体导入自体或异体T细胞,从而表达由抗原识别结构域、铰链区、跨膜区、共刺激信号激活区等组成的嵌合抗原受体(CAR)而形成的一种可以识别某种特定抗原的T细胞。CAR-T 输注到患者体内后,可与肿瘤细胞表面特异性抗原相结合而激活,通过释放穿孔素、颗粒酶等直接杀伤肿瘤细胞达到治疗肿瘤的目的。
目前世界上产业化领先的CAR-T产品是自体细胞治疗产品,产品制备主要流程如图1。
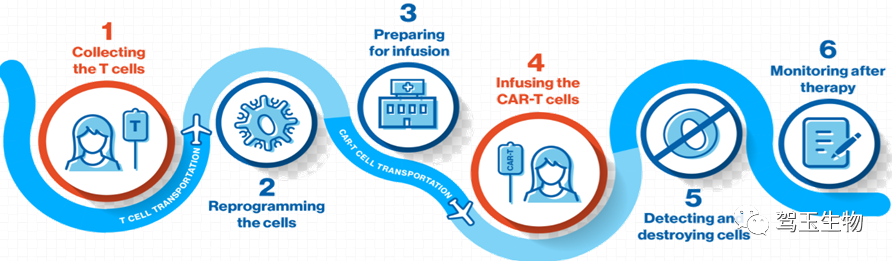
图1:CAR-T产品周期图
由于产品的生产从医院段病人采血开始,CAR- T产品生产的质量管控比传统生物药更为复杂,质量体系应当覆盖产品生产的全过程,包括单采血,血包运输,生产/存储,冷链运输,复融,回输,等各方面的质量控制。
2021年6月,国家药品监督管理局正式批准复星凯特靶向人CD19自体CAR-T细胞治疗产品奕凯达®(阿基仑赛注射液)的新药上市申请,该药品为中国首个获批准上市的细胞治疗类产品,用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤(r/rLBCL)成人患者,包括弥漫性大B细胞淋巴瘤(DLBCL)非特指型(NOS)、原发纵隔大B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤和滤泡性淋巴瘤转化的DLBCL1。驾玉生物致力于GMP质量服务,全方位与复星凯特一起开拓与细胞治疗产品相匹配的创新质量体系与管理,助力中国细胞治疗领域的高质量发展。GMP质量体系的审计从生产端,一直延伸到治疗中心端。在美国Kite(凯特),复星凯特,驾玉生物三方的共同努力下,从2020年12月起,驾玉生物协助完善复星凯特完善阿基仑赛注射液(奕凯达®)商业化运作的临床治疗中心质量认证体系。截至2022年2月,驾玉生物对复星凯特已经完成认证的全国多家治疗中心进行再认证。作为质量体系非常重要的一环,对治疗中心的质量认证将以最大限度地保障患者的用药安全,同时保证高端生物药的有效性。
为规范和指导嵌合抗原受体T细胞(CAR-T)治疗产品申请上市注册时风险管理计划的撰写,国家药审中心组织制定了《嵌合抗原受体T细胞(CAR-T)治疗产品申报上市临床风险管理计划技术指导原则》,并于2022年1月29日发布并实施。为进一步降低 CAR-T 细胞治疗产品的安全风险,保护患者,该指导原则也要求应采取额外风险最小化措施。主要包括上市许可持有人对医疗机构的评估和认证、开展医务人员和患者的教育培训并保证培训效果、发放患者提示卡等。其中对上市许可持有人对医疗机构的评估和认证的要求如下:“为了最大限度地降低与CAR-T 细胞用药相关的安全风险,上市许可持有人应对医疗机构进行评估和认证。应至少包括单采(如需)、输注前处理(如复融、稀释等)、输注、不良反应处理(如急救人员、设备、药品等)等过程的硬件、软件、人员资质等方面。”
CDE发布了最新指导原则,复星凯特与驾玉生物携手走在前沿。复星凯特作为中国CAR-T产业化第一个取得成功的企业,与驾玉生物国家化GMP高端服务有机结合,一同见证中国CAR-T为代表的细胞与基因治疗领域时代的开启。


