9月1日,聚焦于肿瘤学和自身免疫性疾病领域的百奥赛图(北京)医药科技股份有限公司(以下称“百奥赛图”)正式在港交所上市。百奥赛图此次IPO拟发行2175万股,发售价为25.22港元/股,募资金额(扣除发行成本)约为4.71亿港元。所得资金将主要用于推进核心产品YH003和YH001的临床开发(70%)及“千鼠万抗”计划(15%)。
百奥赛图由沈月雷博士和倪健博士联合创办,至今已有13年历史。在这13年中,百奥赛图围绕实验小鼠进行了两次业务模式跃迁。从最早期的基因编辑定制化服务,到2015年转型为基因编辑动物模型的生产供应商以及提供临床前研究服务的CRO公司,再到2019年全人抗体系列小鼠模型(RenMice)研发成功后,开始转型成为一家生物技术和创新药Pipeline公司。
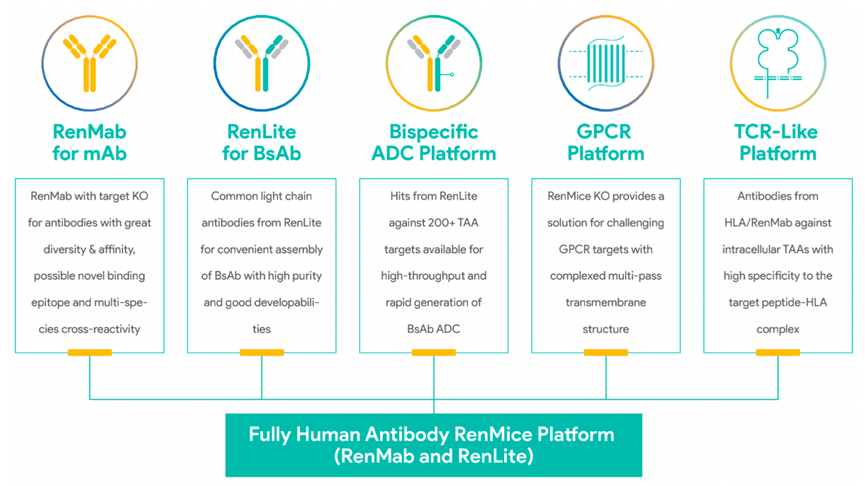
百奥赛图自主开发了超大片段(百万碱基)基因编辑技术(SUPCE技术)突破了基因编辑片段长度的限制,几乎可以实现任意长度、任意位点的精确基因组编辑,将基因编辑技术推向巅峰。依托SUPCE技术,百奥赛图先后开发成功了全人抗体小鼠RenMab平台、共同轻链小鼠RenLite平台、GPCR平台、双抗ADC平台和类TCR平台等一系列原创的技术平台。
全人抗体小鼠平台技术将人类免疫球蛋白基因序列引入到基因编辑小鼠模式的基因组中,使小鼠免疫系统能够自然地产生各种人类抗体。该技术使得更多抗体在人体中无免疫原性,并具有更高的亲和力、稳定性、溶解性及其他药物形成特性。由于全人源抗体的免疫原性低于小鼠、嵌合或人源化单抗,因此未来可能成为首选的单克隆抗体药物类型。据统计,在2016年至2021年6月经FDA批准的44种创新单克隆抗体中,43.2%为全人源单抗。
RenMab平台与再生元VelocImmune平台有异曲同工之妙,而VelocImmune技术可谓是再生元崛起的重要力量,利用其开发的重磅药物度普利尤单抗(Dupixent)已成为赛诺菲年销售额最高的药物。
RenLite平台中,RenLite小鼠重链可变区基因同样被原位替换为人的相应基因,轻链可变区基因被替换为单一人轻链可变区基因。固定轻链并不影响抗体在小鼠体内完成亲和力成熟,可以同野生型小鼠一样,生成具有高亲和力、特异性和多样性的候选抗体分子。基于RenLite小鼠,百奥赛图快速建立起双抗、双抗ADC等独具特色的技术平台。
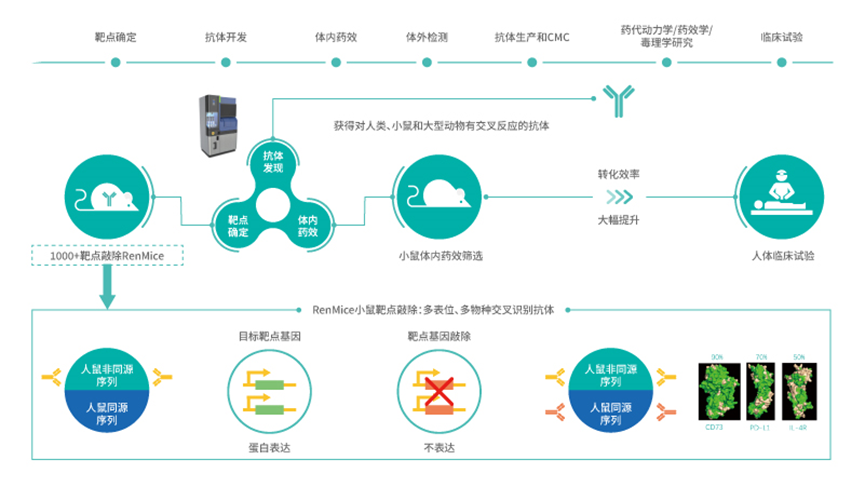
2020年3月,百奥赛图启动了“千鼠万抗”计划,是百奥赛图规模化开发抗体药物的重要里程碑。其目标是利用3-5年时间,基于RenMice靶点敲除小鼠对上千个潜在药物靶点进行规模化抗体药物开发。据弗若斯特沙利文统计,与传统方法相比,“千鼠万抗”计划可以显著加快药物开发过程,例如将从临床前发现到PCC所需时间由平均5.5年减至12至18个月。
截至目前,百奥赛图根据“千鼠万抗”计划已获得12个靶点的PCC分子,并与默克、荣昌生物、华润生物、南京正大天晴、星奕昂、乐普创一等15家国内外合作伙伴签署了24项药物合作开发协议。此外,百奥赛图先后与百济神州、信达生物、美国Xencor等国内外14家药企达成RenMab和/或RenLite等技术平台的授权使用。百奥赛图一步一步证明了它的研发能力。
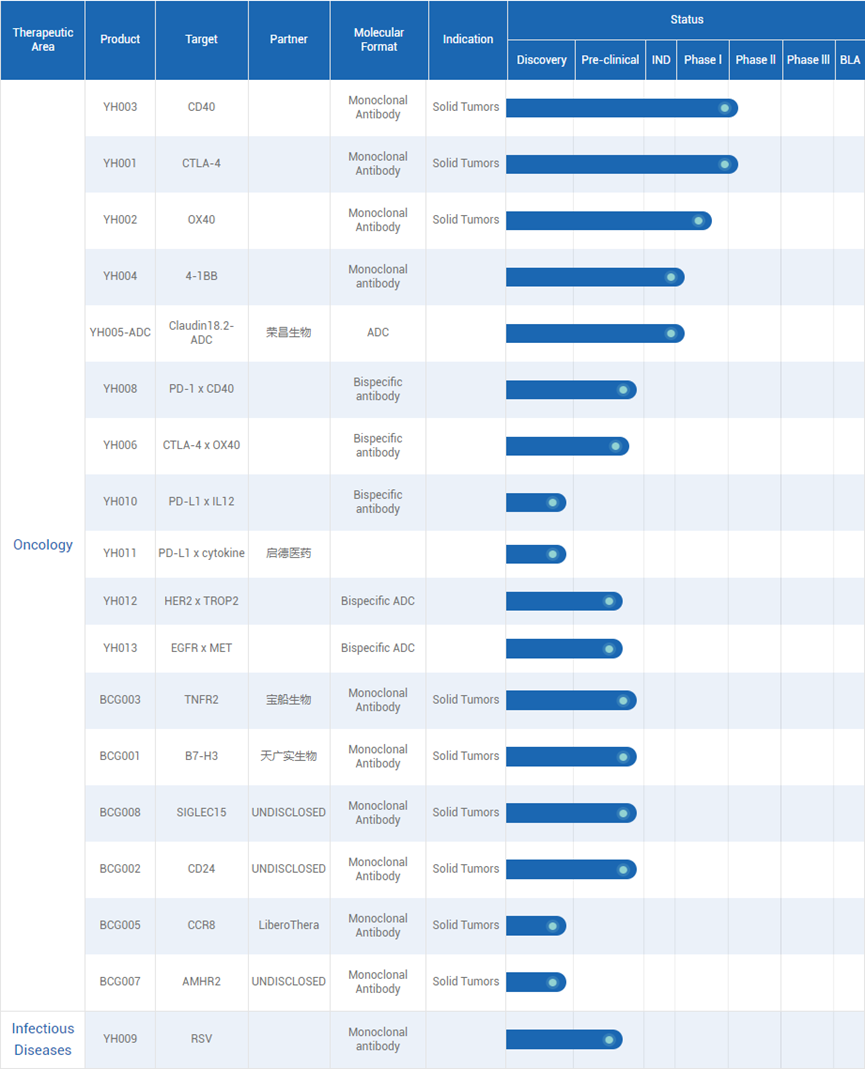
通过其综合抗体开发平台,百奥赛图建立了具备成为first-in-class或best-in-class潜力的多款抗体疗法研发管线。据统计,百奥赛图共19款候选药物在研,其中4款处于I/II期阶段,15款处于pre-IND阶段。
百奥赛图为CD40赛道的重要玩家之一,布局了CD40激动剂抗体、CD40抑制剂抗体、PD-1/CD40双抗等。其核心产品之一便是CD40单抗YH003,具有成为first-in-class产品的潜力。
CD40是一种关键的免疫共刺激受体,在激活先天及适应性免疫系统中起着关键作用,最初被确定为膀胱癌细胞及B细胞的表面标志物。药物激活B细胞上的CD40可模拟内源性免疫激活过程,从而激活内源性免疫系统,逆转癌症患者的免疫抑制作用。
截至目前,全球尚无CD40靶向药物获批上市。据统计,全球在研CD40靶向药共51款,其中31款处于I/II期阶段,1款处于首次IND阶段,19款处于临床前阶段。此外,32/51为抗CD40单克隆抗体药物。
据招股书披露,YH003已在澳大利亚开展了联合特瑞普利单抗治疗实体瘤的I期临床试验,研究达到了主要终点并确定了II期推荐剂量。YH003联合特瑞普利单抗一线和二线治疗胰腺导管腺癌患者以及二线治疗黑色素瘤患者的II期研究正在美国和澳大利亚进行。在中国,YH003也在开展4项单药或联合PD-1及化疗的临床研究,包括2项II期临床。
已披露的临床数据显示,YH003并未观察到其他CD40单抗的安全性问题,如罗氏的CD40抗体Selicrelumab的临床前研究结果显示,在高剂量下Selicrelumab有非常明显的转氨酶升高的肝损伤现象,和严重的细胞因子释放相关的毒性。YH003的特殊之处在于,YH003的安全性优势源于其基于循证体内药效的筛选方法,在百奥赛图人源化小鼠肿瘤模型中筛选到安全性好,疗效也更好的抗体。
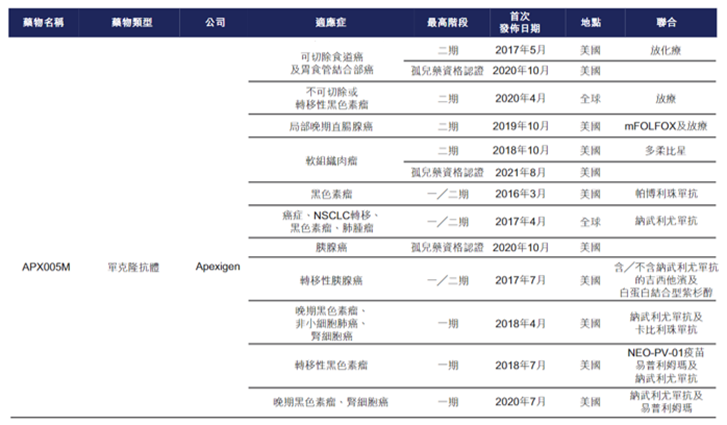
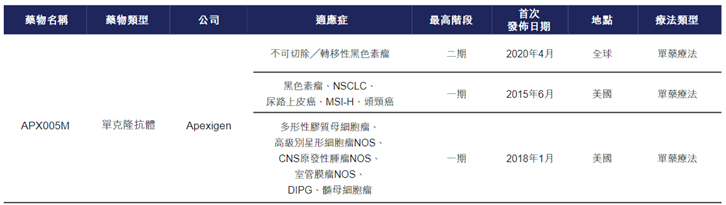
此外,据招股书披露,国外进展最快的是Apexigen公司的sotigalimab(APX005M),目前已有多项适应症进入II期阶段,并先后于2020年和2021年获FDA授予3项孤儿药资格,用于治疗食道和胃食管连接癌、胰腺癌及软组织肉瘤。据百奥赛图估计,仅有YH003和sotigalimab可于2024年实现商业化。
CTLA-4赛道已经日趋拥挤,截至目前,全球共2款CTLA-4抗体药物上市,其中一款为单抗(伊匹木单抗,来自百时美施贵宝),另一款为双抗(卡度尼利单抗,来自康方生物)。
2011年3月,伊匹木单抗在美国获批上市,用于治疗不可切除或转移性黑素瘤,成为首款也是目前唯一一款获批上市的CTLA-4单抗。2021年6月,伊匹木单抗在中国获批上市。然而,由于毒性较高,其临床应用受限。
据招股书披露,YH001联合特瑞普利单抗二线治疗肝细胞癌患者以及一线治疗NSCLC患者的II期临床试验正在启动中。此前披露的I期临床结果显示,相对于已上市及在研的CTLA-4抗体,YH001联合特瑞普利单抗显示更安全的特性。
OX40也是一类免疫共刺激分子,其激动剂通过增加活化T细胞的数目及其效应功能和抑制调节性T细胞来增强免疫反应。截至目前,全球尚无相关产品上市,在研产品共31款,其中进展最快的为安进/协和麒麟合作开发的rocatinlimab,已进入III期阶段。
rocatinlimab是一种抗OX40全人源单克隆抗体,采用协和麒麟的专有POTELLIGENT去岩藻糖基化技术平台设计得到,以增强其抗体依赖性细胞毒性(ADCC)活性。2021年6月,安进与协和麒麟签署协议,共同开发和商业化rocatinlimab。根据协议条款,安进获得rocatinlimab在除日本以外市场的开发、制造和商业化权益。
YH002是一款靶向OX40的激动性单克隆抗体,其独特的抗原结合表位使其成为安全性良好的免疫激活抗体。百奥赛图已在澳大利亚完成YH002的I期剂量递增临床试验。数据显示,YH002在不超过2.0mg/kg的剂量下耐受性良好。此外,研究表明,CTLA-4和OX40在小鼠和人类肿瘤浸润调节性T细胞呈现密度最高,因此YH002联合抗CTLA-4治疗或有更佳疗效。基于此假设,百奥赛图正在澳大利亚进行YH002联合YH001的I期剂量递增研究。
4-1BB是一种表达在免疫系统各种细胞(尤其是CD8+T细胞)上的共刺激受体。抗4-1BB抗体激活4-1BB后可以刺激T细胞和抗原呈递细胞的增殖以及细胞因子的分泌,从而提高抗肿瘤免疫反应。截至目前,全球尚无相关产品上市,在研产品共75款,其中进展最快的为辉瑞和MorphoSys合作开发的utomilumab,已有4项适应症推进至III期阶段。
YH004是一款人源化抗4-1BB IgG1抗体,具有不同于其他抗4-1BB抗体的作用机制,目前正在澳大利亚开展治疗晚期实体瘤及淋巴瘤的I期临床试验。
此外,百奥赛图计划于2023年之前提交候选药物YH006、YH008、YH009、YH010的IND申请。据招股书披露,百奥赛图的副总经理郭朝设博士在发育生物学方面有丰富经验,其研究曾于《临床研究杂志》(JCI)、Development等知名期刊发表;副总经理林庆聪博士有丰富的生物学和基因改造经验。我们的副总经理兼首席科学家杨毅博士有超过10年的研究经验,并曾在《自然》(Nature)等顶级期刊发表多篇论文;抗体开发部高级总监陈磊博士有超过10年的行业经验,曾任职于默克及艾伯维;副总经理庾照学博士有超过15年的研究和技术经验。
此外,祐和医药是百奥赛图的全资子公司,其具有实力出众的临床开发团队,负责百奥赛图新药项目的临床开发。首席医学官陈兆荣博士从事医药研发30余年,具备医学研究、各期药物研发、药物审评和注册等工作经验,曾在澳大利亚药品管理局从事药物审评与审批工作,并在GSK、赛诺菲、拜耳先灵等著名药企担任临床医学部门负责人。首席注册及策略官李志宏博士曾担任美国FDA资深审查员,并曾在辉瑞从事临床研究;首席运营官王铀女士曾担任艾昆纬BDU负责人,并在精鼎医药担任商业开发部中国区负责人和临床运营高级总监兼大客户管理高级总监等职务,具有15年以上的临床运营经验。声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!