2021-03-10 13:52:06Source:荣昌生物Views:721
3月9日,根据中国国家药监局(NMPA)药品注册进度查询结果,荣昌生物自主研发的1类新药泰它西普新药上市申请办理状态已更新为“审批完毕-待制证”,批准文号为:国药准字S20210008。这意味着,这款新药已正式在中国获批。根据NMPA药品审评中心(CDE)优先审评公示,该申请针对的适应症为系统性红斑狼疮。公开资料显示,泰它西普具有全新药物结构和双靶点作用机制,是60多年来首款在中国获批上市的治疗系统性红斑狼疮的中国国产新药,并有望成为中国生物创新药物的“first-in-class”。
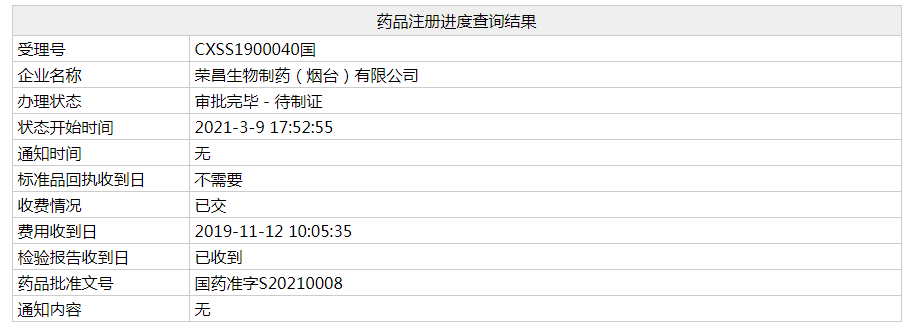
截图来源:NMPA官网
系统性红斑狼疮是严重影响人类健康的重大疾病,但治疗SLE的新药研发异常困难,在过去的几十年中,从跨国公司到初创公司,国际上有很多SLE新药项目,但均以失败告终,没有针对性治疗药物,SLE只能靠糖皮质激素、抗疟药和免疫抑制剂这些对症治疗手段,但疾病控制率并不佳,有将近60%的患者的疾病持续活动或反反复复。同时长期大剂量使用激素带来的副作用使患者生活质量受到严重影响,对于年轻女性来说更是非常痛苦。
公开资料显示,泰它西普是荣昌生物研发的用于治疗自身免疫性疾病的一种新型融合蛋白,能同时抑制BlyS和APRIL两个细胞因子,具有全新的药物结构和双靶点作用机制,能有效抑制B细胞成熟分化,降低机体免疫反应,达到治疗自身免疫性疾病的目的。
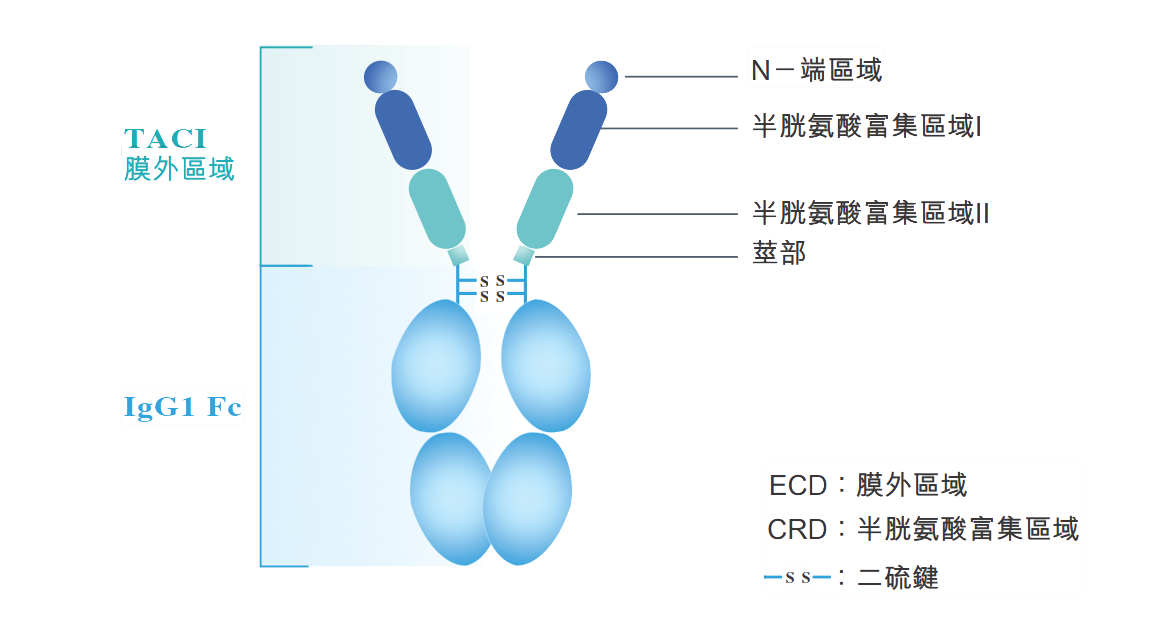
来源:荣昌生物官网
泰它西普于2010年向国家药监局申报临床试验,2011年获得一期临床试验批件,2012年在北京协和医院完成I期临床试验,2013年获国家食品药品监督管理总局Ⅱ、Ⅲ期临床试验批件。
2019年11月,荣昌生物的注射用泰它西普的新药上市申请正式获得CDE承办受理;2019年12月5日,泰它西普的新药上市申请获得CDE优先审评公示。同一天,国际风湿病领域年度盛会——美国风湿病学会(ACR)年会正在美国亚特兰大国际会议中心举办,荣昌生物以及北京协和医院的张奉春教授团队受邀,将泰它西普治疗系统性红斑狼疮的关键临床研究作为“最新突破性进展”在ACR大会万人主会场作口头报告。在该项试验中,主要终点指标是在第48周达到SRI-4(SLE应答者指数4)应答的患者比例。SRI-4应答为SLE临床试验中用于评估疾病活动性及对治疗出现反应的联合终点。
此次泰它西普在中国获得批准,将为中国系统性红斑狼疮患者带来一款全新的疗法。
此外,荣昌生物还在美国开发这款产品。其中,泰它西普的2期临床试验申请已获得FDA批准,该试验也是泰它西普开启全球多中心试验的关键环节。2020年4月,它还获得美国FDA授予的快速通道资格。据悉,荣昌生物计划于2021年上半年开展全球SLE的3期临床试验,包括美国、欧洲及其他国家地区。
除了SLE之外,荣昌生物还在积极开展泰它西普在中国针对六类其他B细胞介导自身免疫性疾病的后期临床试验,包括两项分别针对视神经脊髓炎频谱系疾病(NMOSD)及类风湿性关节炎(RA)的注册性临床研究,两项分别针对IgA肾炎及干燥综合症(SS)等患者人群庞大但仍缺乏有效治疗手段的适应症的II期临床研究,及另外两项分别针对多发性硬化症(MS)及重症肌无力(MG)等难治罕见病的II期临床研究。
来源:荣昌生物
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!