2022-03-01 11:37:05Source:药方舟Views:458
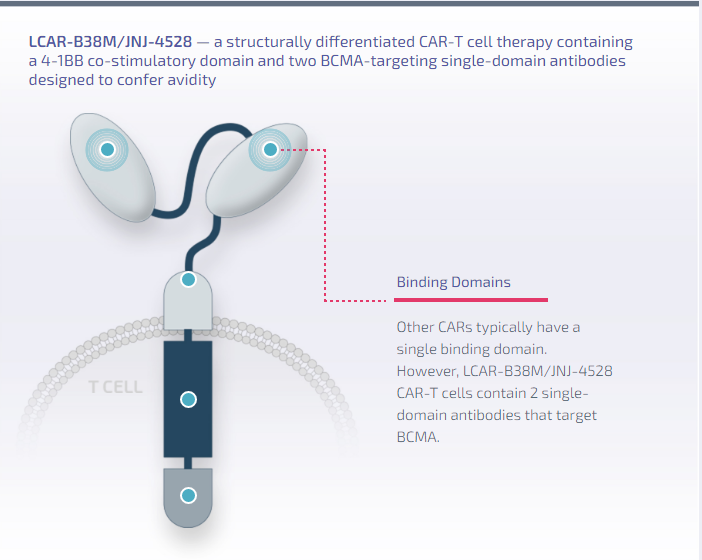
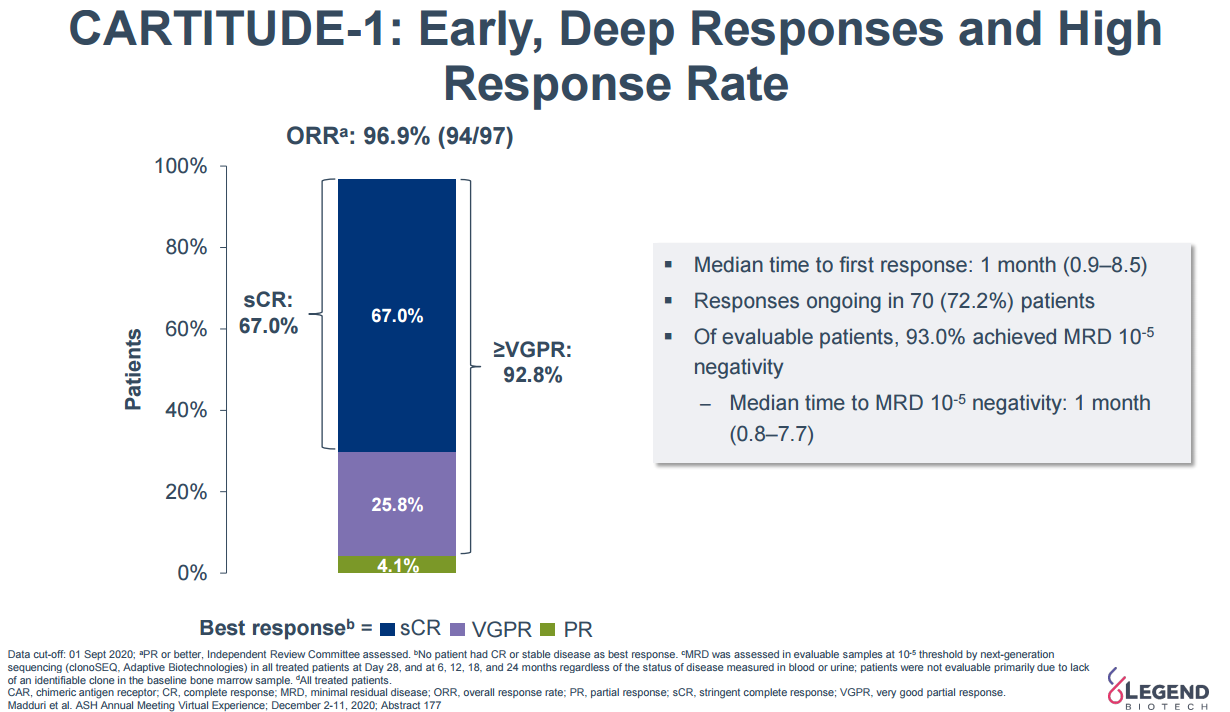
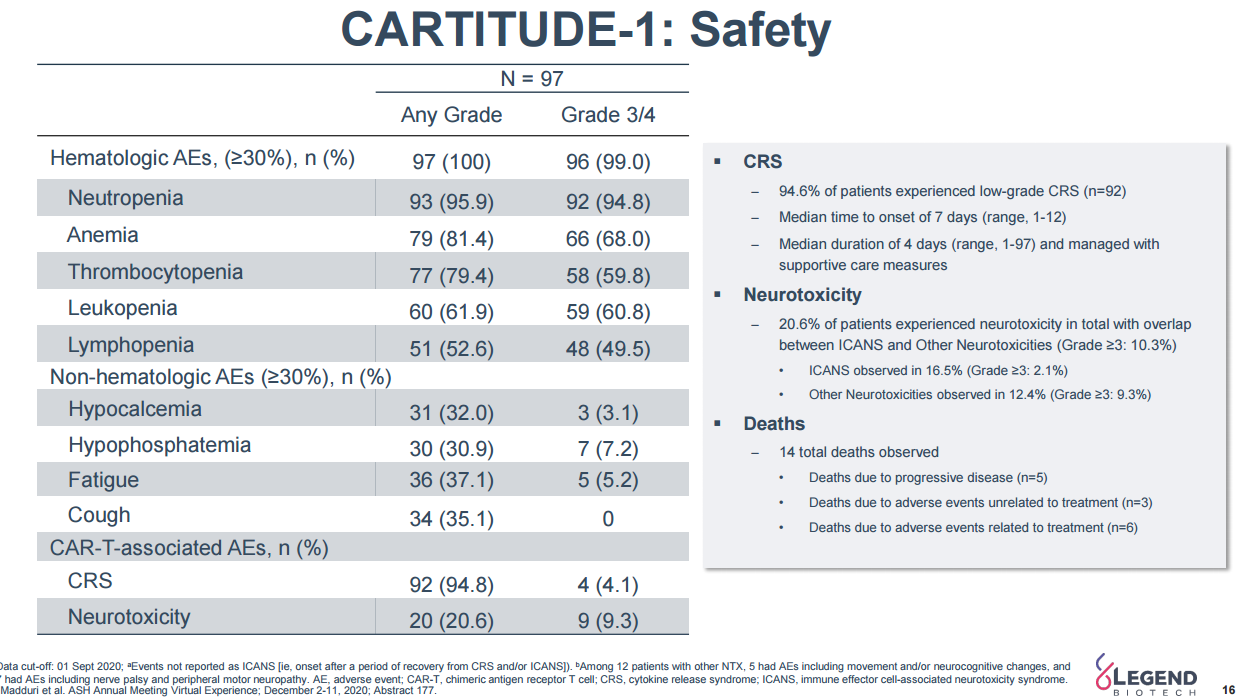
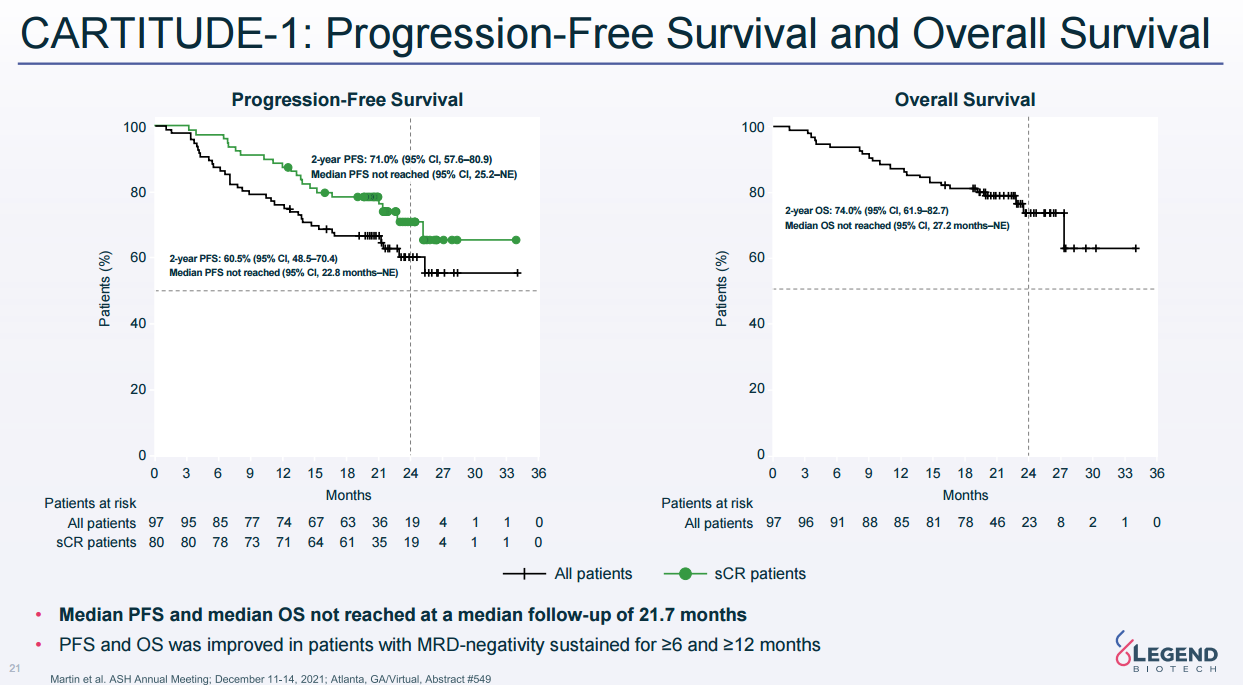
2月28日,传奇生物靶向B细胞成熟抗原(BCMA)的CAR-T疗法西达基奥仑赛(cilta-cel)的生物制品许可申请(BLA)正式获FDA批准,用于治疗复发/难治性多发性骨髓瘤(r/r MM)患者。这是首款获得FDA批准的国产CAR-T细胞疗法。这款药物的获批也是继百济神州泽布替尼之后中国创新药国际化取得的新里程碑和新突破。

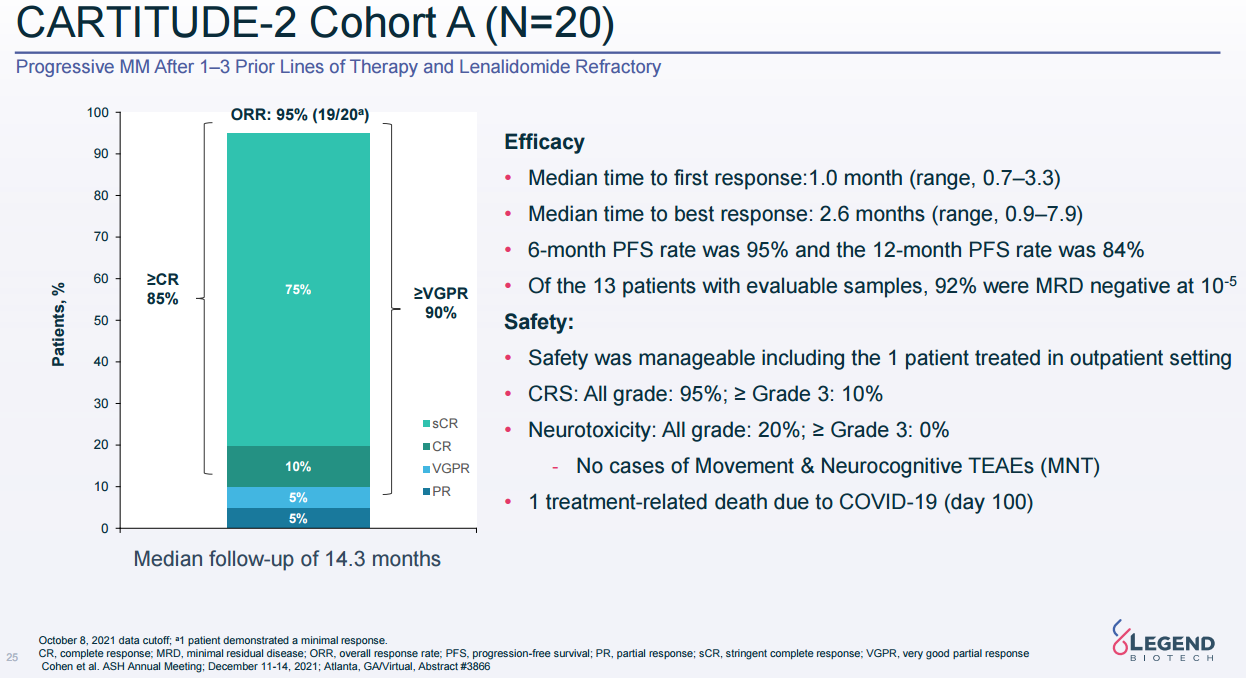
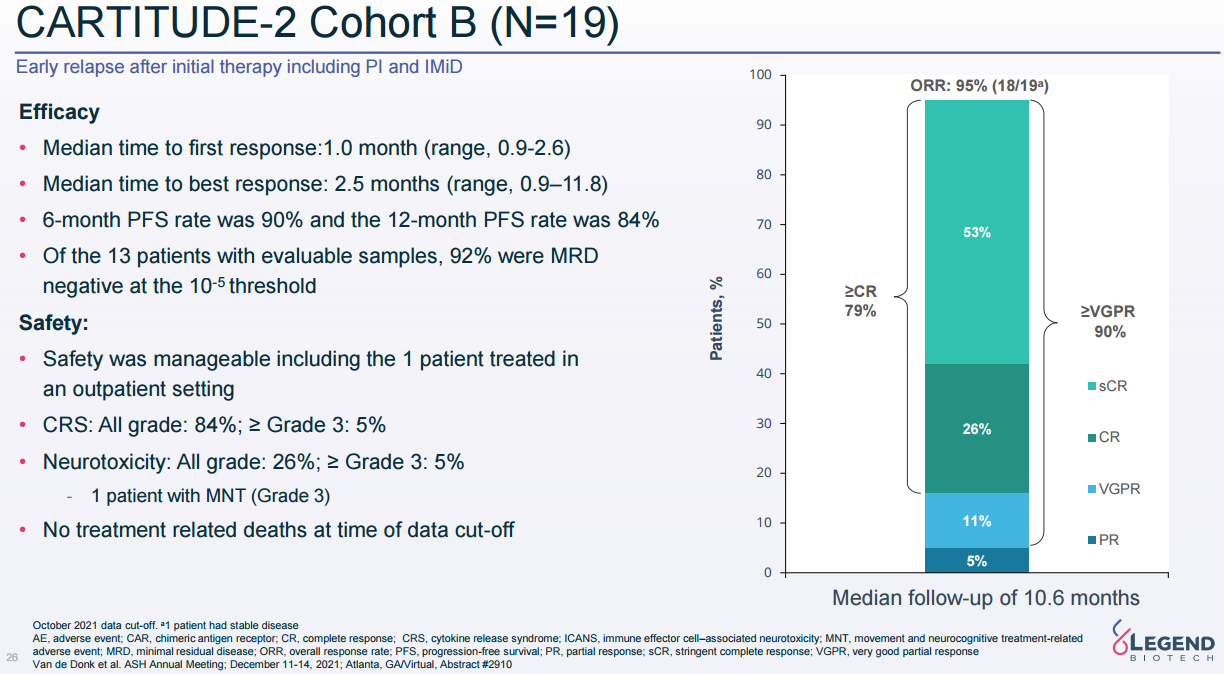
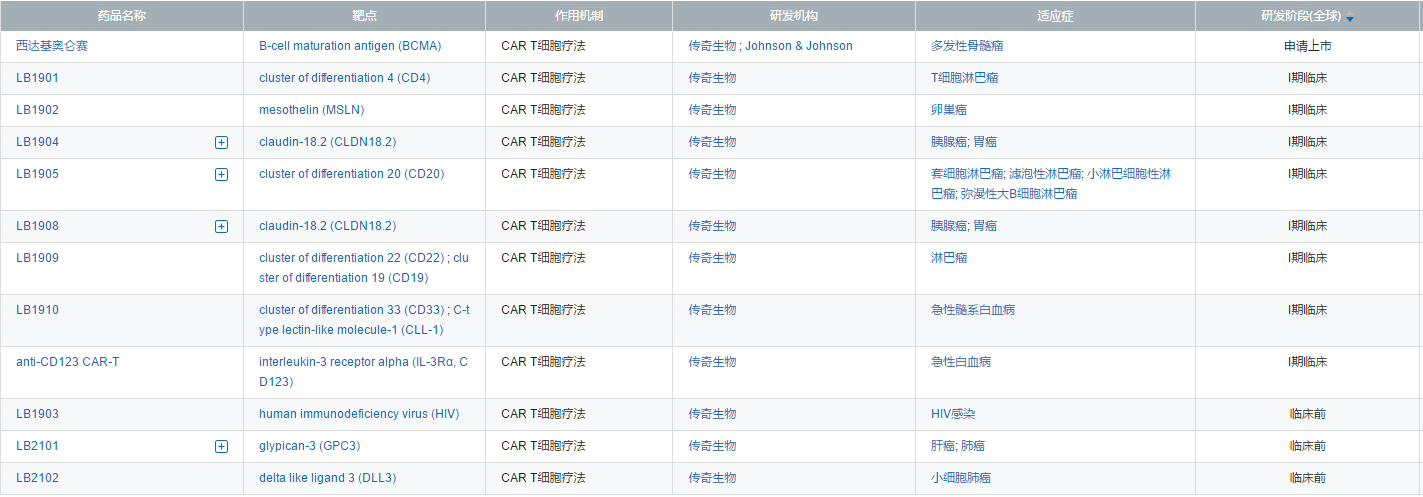
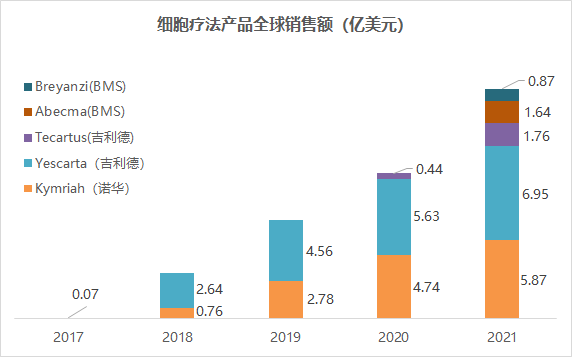
全球上市CAR-T销售额(来源:各公司财报)
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!