2022-07-19 10:44:45Source:医药魔方infoViews:1003
7月15日,Calliditas宣布其Nefecon已获欧盟委员会(EMA)附条件上市许可批准,商品名为Kinpeygo,用于治疗尿蛋白肌酐比≥1.5g/g的成人原发性免疫球蛋白A(IgA)肾病。Nefecon已获EMA孤儿药认证,是EMA批准的第一个且唯一一个治疗IgA肾病的药物。

IgA肾病(IgAN)是一种常见的原发性肾小球疾病,全球成年人发病率至少为2.5例/10万人,而约50%的患者在10-20年内可能进展为终末期肾病(ESRD),后者的标准治疗方法是透析和肾移植,严重影响患者的生活质量。
Nefecon是布地奈德的口服迟释胶囊,是全球首个IgA肾病的靶向治疗药物,用于具有进展风险的成人原发性IgA肾病,降低蛋白尿水平。该产品已于2021年12月率先在美国获批上市。
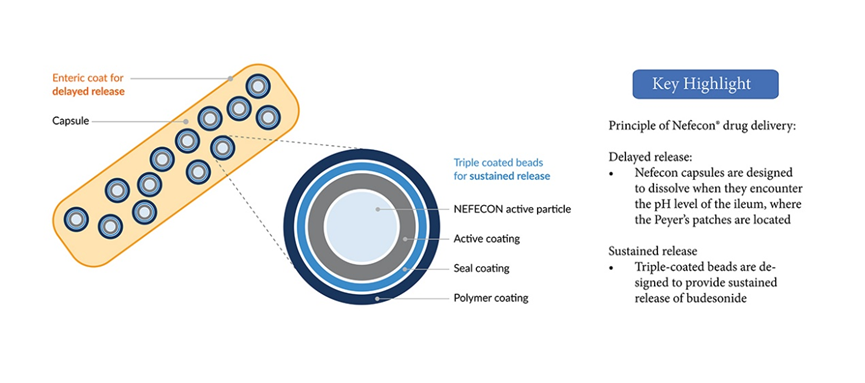
Nefecon的缓释机制
布地奈德(budesonide)是一种具有强糖皮质激素活性和弱盐皮质激素活性的糖皮质激素,首过代谢程度极高。Nefecon专为IgA肾病患者研制,迟释胶囊含布地奈德4 mg,覆以肠溶包衣,使得药物可以完整无损地到达回肠,每粒Nefecon胶囊中所含的布地奈德包衣微丸,靶向作用于回肠末端的黏膜B细胞(包括派尔集合淋巴结),从而减少诱发IgA肾病的半乳糖缺陷的IgA1抗体(Gd-IgA1)产生,进而在发病机制上游阶段治疗IgA肾病。
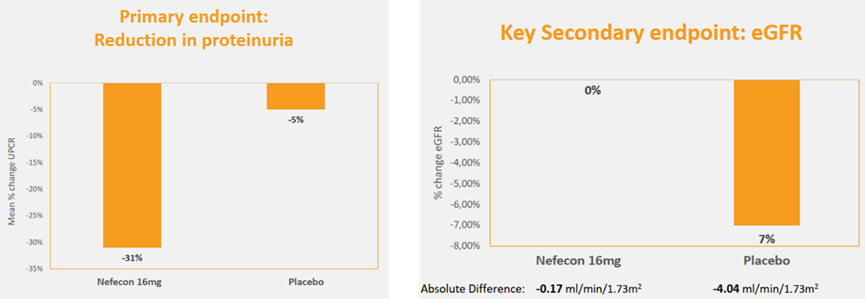
Nefecon的上市批准是基于NeflgArd关键性III期研究A部分的疗效和安全性数据。该研究是一项正在进行的随机、双盲、安慰剂对照、多中心研究临床试验(n=365),旨在评估Nefecon(16mg)每日1次口服给药与安慰剂在原发性IgA肾病成人患者中的疗效和安全性。主要终点为尿蛋白肌酐比值(UPCR),次要终点为肾小球滤过率(eGFR)。
试验结果表明,患者接受每日1次Nefecon(16mg)治疗9个月后,主要终点平均UPCR比基线降低31%,而安慰剂组仅降低5%;次要终点eGFR略有降低(0.17mL/min/1.73m2),而安慰剂组比基线降低4.04mL/min/1.73m2。
2019年6月,云顶新耀与Calliditas签订独家授权许可协议,获得在大中华地区和新加坡开发以及商业化Nefecon的权利。该协议于2022年3月扩展,将韩国纳入云顶新耀的授权许可范围。
2022年4月,云顶新耀公布中国人群亚组接受Nefecon治疗9个月后,蛋白尿下降和稳定eGFR的结果与NefIgArd研究A部分的顶线结果一致。这些数据将被纳入计划于今年下半年递交的中国新药上市许可申请。
Calliditas首席执行官Renée Aguiar-Lucander说:“我们很高兴Kinpeygo在欧洲经济区获得正式批准,成为第一个也是唯一一个EMA批准的治疗IgA肾病的药物。我们期待继续与我们的欧洲合作伙伴Stada合作,因为他们正在为商业化做准备。”
云顶新耀首席执行官薄科瑞博士表示:"祝贺我们的合作伙伴Calliditas取得了又一项重大成绩,将此类疾病的首款治疗药物带给全球更多患有这种慢性疾病的患者。与世界其他地区相比,原发性IgA肾病在亚洲更为常见,人们对创新疗法的需求也更为迫切,我们希望能够尽快在该地区也推出这款重要疗法。"
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!