2022-07-20 13:53:11Source:药方舟Views:357
7月19日,信达生物宣布, 其胰高血糖素样肽-1受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂Mazdutide (IBI362) 在中国2型糖尿病受试者中的一项II期临床(NCT04965506)研究达到主要终点。

这是一项随机、安慰剂/度拉糖肽对照的多中心II期临床,旨在评估Mazdutide在经至少3个月生活方式干预伴或者不伴稳定剂量二甲双胍治疗后糖化血红蛋白(HbA1c)仍不达标的中国2型糖尿病受试者中的有效性和安全性。研究共入组252例受试者,随机接受Mazdutide 3.0 mg、4.5 mg或6.0 mg、安慰剂或度拉糖肽1.5 mg,每周一次皮下注射给药,连续给药20周(含4周或8周滴定期)。主要终点为与安慰剂相比,连续给药20周后HbA1c较基线的变化。各组受试者平均糖尿病病史为4.0~5.7年,HbA1c基线平均值在7.94%~8.16%之间。
结果显示,与安慰剂相比,Mazdutide各剂量组均能显著降低受试者HbA1c水平(与安慰剂组相比, p值均小于0.0001)。在受试者的体重管理方面,与安慰剂相比,Mazdutide各剂量均可显著降低体重,且呈现剂量依赖性。给药20周后,Mazdutide 6.0mg组体重较基线百分比变化的最小二乘均值为−7.14%(95%CI:−8.49, −5.79),度拉糖肽1.5mg组为−2.69%(−4.02, −1.37),安慰剂组为−1.38%(−2.70, −0.06),与度拉糖肽组和安慰剂组相比,p值均小于0.0001;Mazdutide 6.0mg 组HbA1c<7.0%且体重较基线下降≥5%的受试者比例高达52.2%(度拉糖肽1.5 mg组为14.0%,安慰剂组为0%。
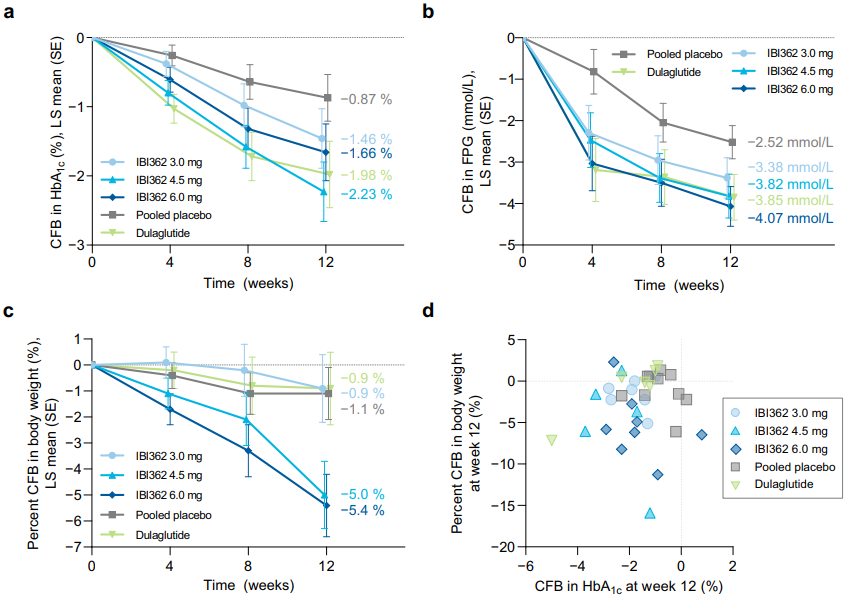
HbA1c、空腹血糖和体重随时间的变化
同时,Mazdutide还可降低空腹血糖、餐后血糖、血压、低密度脂蛋白胆固醇和甘油三酯等指标,并改善胰岛素敏感性,为患者带来全面获益。
Mazdutide总体安全性和耐受性良好,无受试者因不良事件提前退出研究。研究期间未发生重度低血糖事件。整体安全性特征与Mazdutide的既往研究和其他GLP-1受体激动剂类药物相似。最常报告的治疗期不良事件包括食欲减退、恶心、呕吐和腹泻,多为轻度或中度且呈一过性特征。
Mazdutide是信达生物与礼来制药共同推进的一款胃泌酸调节素创新化合物(OXM3),在同类产品中具有最优潜力。作为一种与哺乳动物胃泌酸调节素类似的长效合成肽,Mazdutide利用脂肪酰基侧链延长作用时间,允许每周给药一次。Mazdutide的作用被认为是通过GLP-1R和GCGR的结合和激活介导的,与OXM具有相似作用机制,因此预计其可以改善葡萄糖耐量并减轻体重。除了GLP-1R激动剂具有的促进胰岛素分泌、降低血糖和减轻体重等作用外,Mazdutide还可能通过GCGR的激活来增加能量消耗和改善肝脏脂肪代谢。
信达生物临床副总裁钱镭博士表示:“Mazdutide是首个兼具强效降糖和减重疗效的周制剂GLP-1R/GCGR双重激动剂。Mazdutide在中国2型糖尿病患者中的II期研究达到主要终点,其在降糖、减重和综合代谢获益方面的优势得到全面验证,并展现出良好的安全性。这为我们即将开展的III期临床研究奠定了坚实的基础,值得指出的是,我们在临床II期研究中就实现了和度拉糖肽(1.5mg)的对比,并获得了振奋人心的结果,这充分展现了申办方对Mazdutide的信心。在与监管机构充分沟通的基础上,我们将更加积极的推进III期临床研究,期待能早日为中国的医生和糖尿病患者带来新的临床药物选择。”
参考文献:
https://doi.org/10.1038/s41467-022-31328-x
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!