8月16日,中国国家药监局药品审评中心(CDE)官网公示,默沙东(MSD)公司的1类新药MK-4830注射液获得一项临床试验默示许可,拟开发用于治疗晚期实体瘤。公开资料显示,MK-4830是一款在研ILT4抑制剂,正在海外开展2期临床试验。
ILT4又称白细胞免疫球蛋白样受体B2(LILRB2),主要在髓系细胞上表达,包括单核细胞、巨噬细胞、树突状细胞和嗜中性粒细胞。ILT4的典型配体是人类白细胞抗原G(HLA-G),这是一种在多种肿瘤中表达的非经典MHC I类分子,其表达与患者的不良预后相关。研究发现,在实体瘤中,ILT4可以与其配体HLA-G、ANGPTLs、SEMA4A和CD1d相互作用,诱导髓系细胞产生耐受性表型,从而抑制T细胞的活化,并导致肿瘤免疫逃逸。因此,抑制ILT4有助于提升抗肿瘤效果。MK-4830是默沙东开发的一种全人源化免疫球蛋白G4(IgG4)单克隆抗体。它可特异性结合ILT4,并阻断其与HLA-G和其它配体的相互作用。临床前数据表明,MK-4830可与健康志愿者和癌症患者外周血中的单核细胞和粒细胞结合。在人源化小鼠肿瘤模型中,用MK-4830治疗可显著抑制肿瘤生长。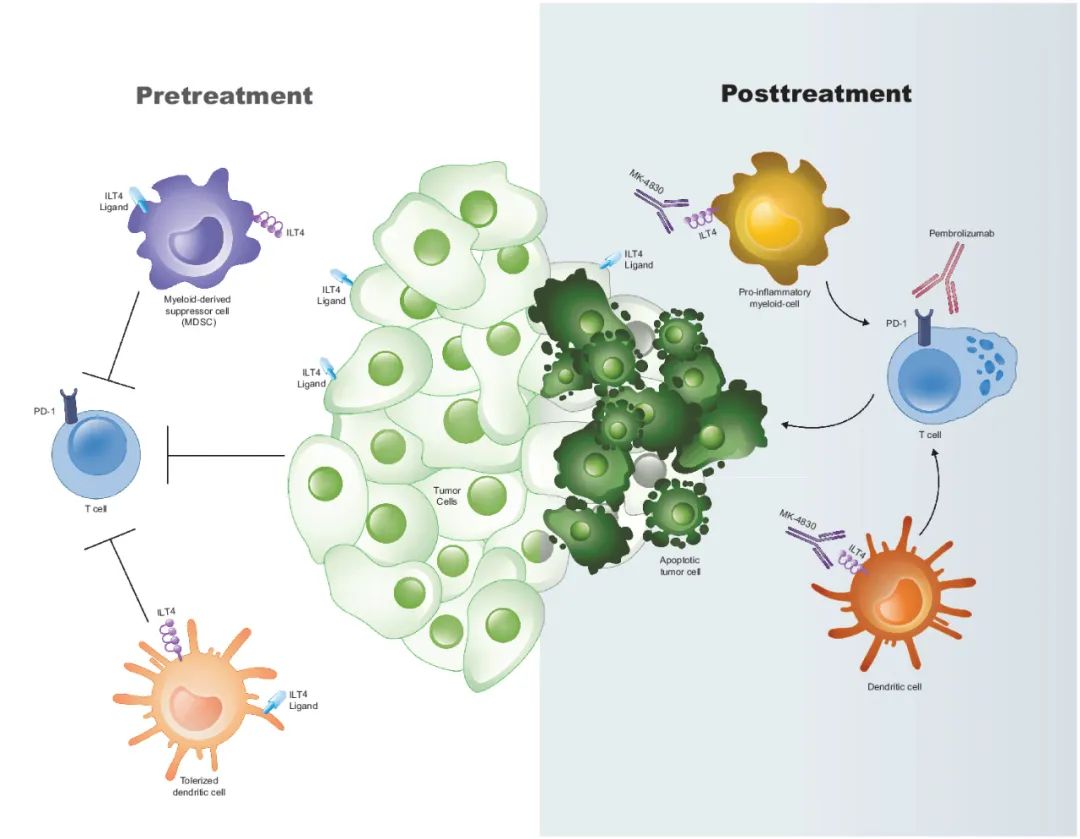
▲MK-4830作用机制示意图(图片来源:参考资料[2])
2022年1月,Clinical Cancer Research发表了MK-4830在实体瘤中的首次人体临床试验数据。该试验评估了MK-4830单药或者与PD-1抑制剂pembrolizumab联合治疗实体瘤的安全性和初步疗效。研究共纳入84例患者,其中50例患者接受单药治疗,34例患者接受联合治疗。试验未观察到剂量限制性毒性,且未达到最大耐受剂量。在34名接受联合治疗的剂量递增期患者中,有11名患者达到客观缓解。目前,默沙东正在探索MK-4830单药或者联合其它药物治疗多种实体瘤的效果。其中,针对黑色素瘤、结直肠癌、小细胞肺癌、非小细胞肺癌、肾细胞癌、卵巢癌等的研究均已进入到2期阶段。本次获得临床试验默示许可意味着该药也即将在中国进入临床研究。参考资料
[1] 中国国家药监局药品审评中心(CDE)官网. Retrieved Aug 16,2022, from https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2] First-in-Class Anti-immunoglobulin–like Transcript 4 Myeloid-Specific Antibody MK-4830 Abrogates a PD-1 Resistance Mechanism in Patients with Advanced Solid Tumors Retrieved Jan 01,2022, from https://aacrjournals.org/clincancerres/article/28/1/57/675028/First-in-Class-Anti-immunoglobulin-like-Transcript
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!

