2022-10-09 09:52:36Source:医药魔方Views:264
10月8日,礼来宣布,其高选择性RET抑制剂塞普替尼获得NMPA批准,用于治疗转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者、需要系统性治疗的晚期或转移性RET突变型甲状腺髓样癌(MTC)成人和12岁及以上儿童患者、以及需要系统性治疗且放射性碘难治(如果放射性碘适用)的晚期或转移性RET融合阳性甲状腺癌(TC)成人和12岁及以上儿童患者。
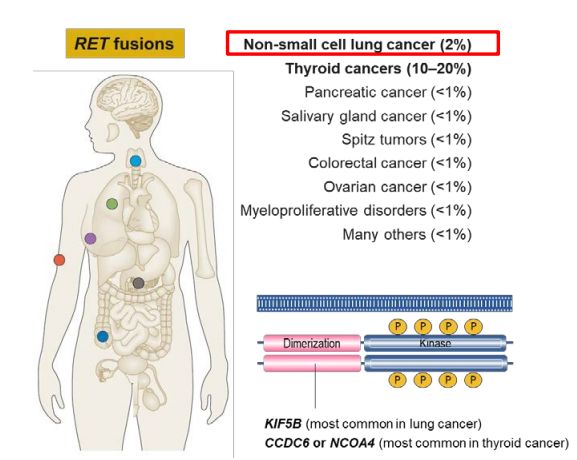
RET融合和突变发生在多种肿瘤类型中,包括肺癌、甲状腺癌以及其他一些肿瘤类型中。据估计,RET基因融合在NSCLC患者中的发生率约为1%~2%,在甲状腺乳头状癌(占所有甲状腺癌的85%左右)中的发生率为10%~20%,在甲状腺髓样癌中的发生率为60%左右。
塞普替尼是Loxo Oncology开发的一款高度特异性口服RET抑制剂,用于治疗携带RET基因融合或激活性突变的肿瘤类型。2019年1月,礼来花费80亿美元收购Loxo Oncology公司,从而获得了该靶向疗法。2020年5月8日,FDA加速批准塞普替尼上市,成为首个获批靶向RET的肿瘤疗法。
本次获批基于全球研究LIBRETTO-001数据和LIBRETTO-321研究中国人群数据。LIBRETTO-001研究是一项评估塞普替尼治疗RET驱动型癌症患者的最大规模的全球I/II期临床试验,该研究纳入了初治患者和经治的各种晚期实体肿瘤患者,共计702例。LIBRETTO-001研究主要终点为客观缓解率(ORR)和中位缓解持续时间(DoR),试验结果如下:
图片来源:礼来官方微信 LIBRETTO-001研究结果显示,对于RET融合阳性的局部晚期或转移性NSCLC患者、RET突变型的晚期或转移性MTC患者、RET融合阳性的晚期或转移性TC患者,塞普替尼均具有缓解率高,持续时间久的优势。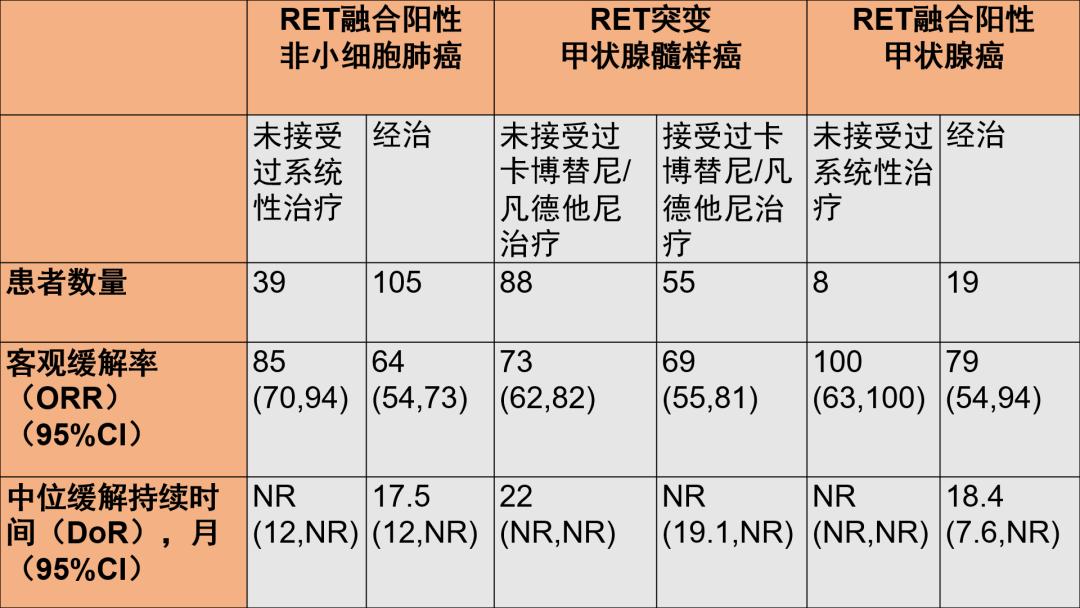
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容