2021-07-05 15:42:59Source:药方舟Views:276
导读:摘要:2021上半年FDA批准药物报告
创新推动进步,时代引领发展。每年FDA(美国食品药品管理局,以下统称FDA)都要批准多种新药和生物制品以促进医疗保健的进步和民众健康发展。本文主要介绍在2021年上半年,经由CDER(FDA药物审评和研究中心)批准的多种新药及部分生物制品,为广大制药企业提供数据支持,提供市场参考。
新药分布
2021年1月至6月,美国FDA共计批准了52款新药,6款生物制品(CDER批准)。按照企业提交的申请分类包括新分子实体类占比50%,新酯新盐类或其他非共价键的衍生物类5%,新剂型10%,新配方26%,其他类(新药物组合等)9%。近半年来,其批准的新药药理主要分布在系统用抗感染药类、神经系统类、心血管系统类以及消化道代谢和抗肿瘤药等领域。如下图展示了近半年以来,FDA批准的新药和部分生物制品的趋势图。
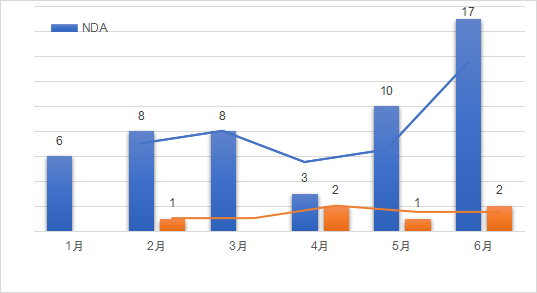
数据来源:药智数据,药智咨询整理
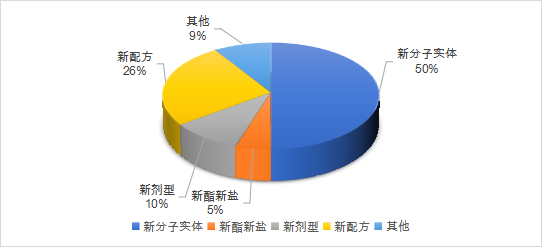
数据来源:药智数据,药智咨询整理
其中,商品名称MAVYRET和EPCLUSA这两款新药为美国FDA首次批准,都为新剂型类药物,并已获得了FDA的孤儿药认定。MAVYRET是格卡瑞韦和哌仑他韦的固定剂量组合药物,由艾伯维制药持有并于2021年6月获得FDA的上市批准,主要治疗慢性丙型肝炎病毒。EPCLUSA是一种核苷酸类似物聚合酶抑制剂和泛基因型NS5A抑制剂的固定剂量组合药物(索磷布韦和维帕他韦),由吉利德科学公司持有并于2021年6月获得FDA的上市批准,同样也用于慢性丙型肝炎病毒的治疗。
中国药企
中国药企在2021年上半年中,有超过20家企业拿到了FDA授予的上市批准,有30个品种(多以注射剂和片剂为主)通过了FDA仿制药上市批准,同比下降16%。复星医药执掌牛耳,共计有9款仿制药在美国获批上市。
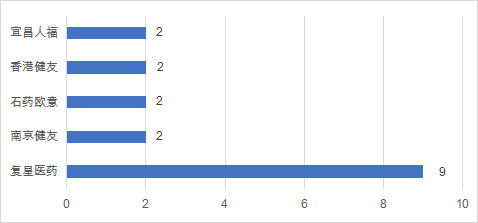
数据来源:药智数据,药智咨询整理
以下为2021年上半年FDA批准新药和部分生物制品的数据(参考)。
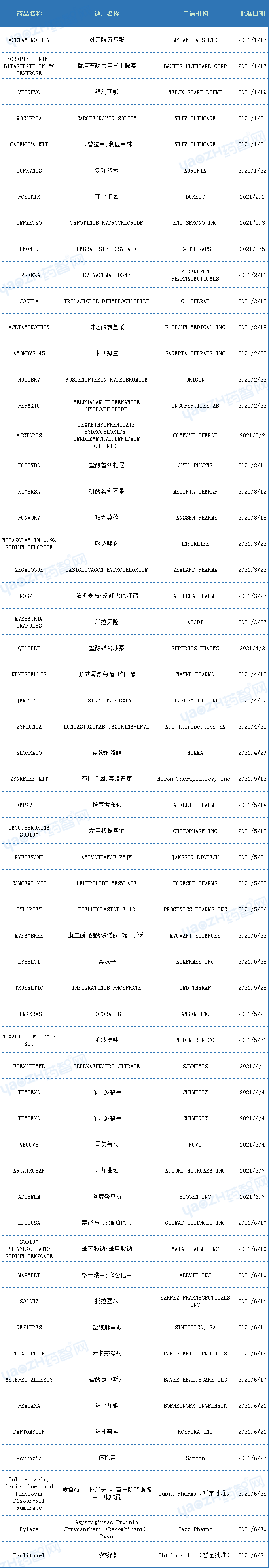
数据来源:药智美国上市药品数据库、Drugs@FDA
想要了解更多信息,请登录药智企业版美国上市药品数据库查询,如有不足,敬请指正。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!